Tổng hợp công thức Hóa học lớp 12 Các công thức Hóa học 12
Công thức Hóa 12 tóm tắt toàn bộ công thức hóa học của 8 chương trong SGK Hóa học 12 hiện hành như: Este - Lipit, Cacbohiđrat, Amin, amino axit và protein, Polime và vật liệu polime, Đại cương về kim loại, Kim loại kiềm, kim loại kiềm thổ, nhôm, Sắt và một số kim loại quan trọng.
Tóm tắt công thức Hóa học 12 được biên soạn rất chi tiết cụ thể theo từng chương rất phù hợp để các em học sinh dễ dàng học thuộc. Thông qua công thức hóa học lớp 12 các em nắm vững kiến thức từ đó biết cách vận dụng vào giải các bài tập thực hành. Đồng thời giải nhanh các bài tập trong các kì thi sắp tới. Vậy sau đây là tóm tắt công thức Hóa học lớp 12, mời các bạn cùng theo dõi tại đây.
Tổng hợp công thức Hóa học lớp 12
I. Một số công thức hóa học cần nhớ
*Mối quan hệ giữa số mol(n) thể tích dd (Vdd) và nồng độ mol CM
![]()
*Mối quan hệ giữa số mol(n), khối lượng (m) và khối lượng Mol(M):
![]()
*Mối quan hệ giữa số mol khí và thể tích khí ở đktc.
![]()
* Số trieste tạo từ n axit và Glixerol = ![]()
II. Một số công thức tính nhanh số đồng phân
1. Cách tính số đồng phân Ankin CnH2n-2 (n ≥ 2)
- Ankin là những hiđrocacbon không no, mạch hở, trong phân tử chứa một liên kết ba.
- CTTQ: CnH2n-2 (n ≥ 2).
- Ankin có đồng phân mạch C, đồng phân vị trí nối ba và không có đồng phân hình học.
- Mẹo tính nhanh đồng phân ankin:
Xét 2C mang nối ba, mỗi C sẽ liên kết với 1 nhóm thế (giống hoặc khác nhau).
Ví dụ với C4H6: Trừ đi 2C mang nối ba sẽ còn 2C và H là nhóm thế.
| C1 | C2 | |
| 1C | 1C | 1 đồng phân |
| 2C | H | 1 đồng phân |
Ta có 2 đồng phân ankin.
2) Số đồng phân ancol đơn chức no CnH2n+2O:
Công thức:
Số ancol CnH2n+2O = 2n-2 (n < 6)
Ví dụ: Tính số đồng phân ancol no, đơn chức, mạch hở từ C3 → C5
C3H7OH: 23-2 = 2 đồng phân.
3) Số đồng phân andehit đơn chức no CnH2nO:
Công thức:
Số andehit CnH2nO = 2n-3 (n < 7)
Áp dụng: Tính số đồng phân anđehit sau: C3H6O, C4H8O.
C3H6O, C4H8O là công thức của anđehit no, đơn chức, mạch hở.
Với C3H6O: 23-3 = 1 đồng phân: CH3CH2CHO
Với C4H8O: 24-3 = 2 đồng phân: CH3CH2CH2CHO; (CH3)2CHCHO
4) Số đồng phân axit cacboxylict đơn chức no CnH2nO2:
Công thức:
Số axit CnH2nO2 = 2n-3 (n < 7)
5) Số đồng phân este đơn chức no CnH2nO2:
Công thức:
Số este CnH2nO2 = 2n-2 (n < 5)
6) Số đồng phân amin đơn chức no CnH2n+3N:
Công thức:
Số amin CnH2n+3N = 2n-1 (n < 5)
III. Công thức Hóa 12 chương 1, 2, 3, 4
ESTE – LIPIT
Khi thay nhóm OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR thì được este
Công thức tổng quát của este
a/ Trường hợp đơn giản: là este không chứa nhóm chức nào khác, ta có các công thức như sau
Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đơn chức R'OH: RCOOR'.
Tạo bởi axit cacboxylic đa chức R(COOH)a và ancol đơn chức R'OH: R(COOR')a
Tạo bởi axit cacboxylic đơn chức RCOOH và ancol đa chức R'(OH)b: (RCOO)bR'
Tạo bởi axit cacboxylic đa chức R(COOH)a và ancol đa chứcR'(OH)b: Rb(COO)abR'a.
Trong đó, R và R' là gốc hiđrocacbon (no, không no hoặc thơm); trường hợp đặc biệt, R có thể là H (đó là este của axit fomic H-COOH).
b/ Trường hợp phức tạp: là trường hợp este còn chứa nhóm OH (hiđroxi este) hoặc este còn chứa nhóm COOH (este - axit) hoặc các este vòng nội phân tử … Este trong trường hợp này sẽ phải xét cụ thể mà không thể có CTTQ chung được. Ví dụ với glixerol và axit axetic có thể có các hiđroxi este như HOC3H5(OOCCH3)2 hoặc (HO)2C3H5OOCCH3; hoặc với axit oxalic và metanol có thể có este - axit là HOOC-COOCH3.
c/ Công thức tổng quát dạng phân tử của este không chứa nhóm chức khác
Nên sử dụng CTTQ dạng CnH2n+2-2ΔO2n (trong đó n là số cacbon trong phân tử este n ≥ 2, nguyên; Δ là tổng số liên kết π và số vòng trong phân tử Δ ≥ 1, nguyên; a là số nhóm chức este a ≥ 1, nguyên), để viết phản ứng cháy hoặc thiết lập công thức theo phần trăm khối lượng của nguyên tố cụ thể.
Este đơn chức RCOOR,Trong đó R là gốc hidrocacbon hay H; R’ là gốc hidrocacbon
Este no đơn chức CnH2nO2 ( với n ≥ 2)
Tên của este:
Tên gốc R’ + tên gốc axit RCOO (đuôi at)
Vd: CH3COOC2H5
Etylaxetat
CH2=CH- COOCH3 metyl acrylat
1. Công thức tổng quát của este no, đơn chức, hở: CnH2nO2 (n ≥ 2)
2. Tính số đồng phân este đơn chức no:
Số đồng phân este CnH2nO2 = 2n-2 (điều kiện: 1 < n < 5)
3. Tính số triglixerit tạo bởi gilxerol với các axit cacboxylic béo:
Số trieste =![]()
CHƯƠNG II: CACBOHIĐRAT
1. Công thức chung của cacbohiđrat: Cn(H2O)m
2. Công thức cụ thể của một số cacbohiđrat:
+ Tinh bột (hoặc xenlulozơ): (C6H10O5)n hay C6n(H2O)5n.
+ Glucozơ (hoặc fructozơ): C6H12O6 hay C6(H2O)6.
+ Saccarozơ (hoặc mantozơ): C12H22O11 hay C12(H2O)11.
CHƯƠNG III: AMIN, AMINO AXIT VÀ PROTEIN
1. Công thức tổng quát amin no, đơn chức, hở: CnH2n+1NH2 hay CnH2n +3N (n ≥ 1)
2. Tính số đồng phân amin đơn chức no:
Số đồng phân amin CnH2n +3N =2n -1 (điều kiện: n < 5).
3. Tính số đi, tri, tetra …, n peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau:
Số n peptitmax = xn
4. Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol HCl, sau đó cho dung dịch sau phản ứng tác dụng vừa đủ với b mol NaOH:
![]()
Lưu ý: (A): Amino axit (NH2)nR(COOH)m.
5. Tính khối lượng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol NaOH, sau đó cho dung dịch sau phản ứng tác dụng vừa đủ với b mol HCl:
![]()
CHƯƠNG IV: POLIME VÀ VẬT LIỆU POLIME
Công thức tính hệ số trùng hợp polime
Giả sử polime có dạng (-A-)n
Ta có:
![]()
IV. Công thức Hóa 12 chương 5
1. Dãy hoạt động hóa học của kim loại
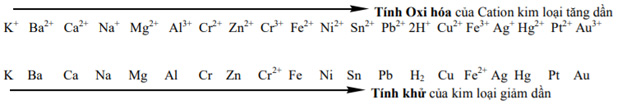
2. Quy tắc anpha
- Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa).
- Áp dụng quy tắc alpha
Phản ứng xảy ra theo chiều mũi tên như sau:
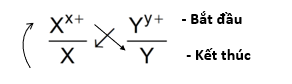
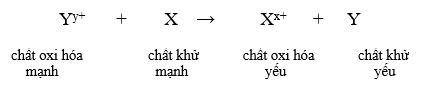
3. Công thức biểu diễn định luật Faraday
Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất.
![]()
Trong đó:
m: khối lượng chất giải phóng ở điện cực (gam)
A: khối lượng mol nguyên tử của chất thu được ở điện cực
n: số electron mà nguyên tử hoặc ion đã cho hoặc nhận
I: cường độ dòng điện (A)
t: thời gian điện phân (s)
F: hằng số Faraday là điện tích của 1 mol electron hay điện lượng cần thiết để 1 mol electron chuyển dời trong mạch ở catot hoặc ở anot (F = 1,602.10-19.6,022.1023 ≈ 96500 C.mol-1)
V. Công thức Hóa 12 chương 6
1. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2:
nkết tủa = nOH- – nCO2 |
Lưu ý: Điều kiện áp dụng công thức: nkết tủa < nCO2.
2. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2:
Trước hết tính nCO32- = nOH- – nCO2
Sau đó so sánh với nBa2+ hoặc nCa2+ để xem chất nào phản ứng hết
Điều kiện áp dụng công thức: nCO32- < nCO2
3. Tính VCO2 cần hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu:
Trường hợp 1: nCO2 = n↓
Trường hợp 2: nCO2 = nOH- – n↓
4. Tính Vdd NaOH cần cho vào dd Al3+ để xuất hiện lượng kết tủa theo yêu cầu:
Trường hợp 1: nOH- = 3n↓ Trường hợp 2: nOH- = 4n Al3+ – n↓ |
Lưu ý: Hai kết quả trên tương ứng với hai trường hợp NaOH dùng thiếu và NaOH dùng dư.
Trường hợp 1 ứng với kết tủa chưa đạt cực đại;
Trường hợp 2 ứng với kết tủa đã đạt cực đại sau đó tan bớt một phần.
5. Tính Vdd HCl cần cho vào dd Na[Al(OH)]4 (hoặc NaAlO2) để xuất hiện lượng kết tủa theo yêu cầu:
Trường hợp 1: nH+ = n↓ Trường hợp 2: nH+ = 4nNa[Al(OH)]4- – 3n↓ |
VI. Công thức Hóa học 12 chương 7
1. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
m muốisunfat = m hỗn hợp KL + 96.nH2 |
2. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl giải phóng H2:
m muối clorua = mhỗn hợp KL +71.nH2 |
3. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
mmuối sunfat = mhỗn hợp KL + 80.nH2SO4
4.Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dd HCl:
m muối clorua = mhỗn hợp KL + 27, 5.nHCl |
5. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl vừa đủ:
m muối clorua = mhỗn hợp KL + 35,5.nHCl |
6. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
mmuối= mKL +96.nSO
7. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
mmuối= mKL + 96.(nSO2 + 3nS + 4nH2S) |
8. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:
nHNO3 = 4nNO + 2nNO2 + 10nN2O +12nN2 +10nNH4NO3 |
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Giá trị nHNO3 không phụ thuộc vào số kim loại trong hỗn hợp.
+) Công thức này chỉ dùng khi cho hỗn hợp kim loại tác dụng với HNO3.
+) Chú ý khi tác dụng với Fe3+ vì Fe khử Fe3+ về Fe2+ nên số mol HNO3 đã dùng để hoà tan hỗn hợp kim loại nhỏ hơn so với tính theo công thức trên. Vì thế phải nói rõ HNO3 dư bao nhiêu %.
9. Tính số mol H2 SO4 đặc, nóng cần dùng để hoà tan 1 hỗn hợp kim loại dựa theo sản phẩm khử SO2 duy nhất:
nH2SO4 = 2nSO2 |
10. Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3 (không có sự tạo thành NH4NO3):
mmuối = mKL + 62.(3nNO + nNO2 + 8nN2O +10nN2) |
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Nếu có sự tạo thành NH4NO3 thì cộng thêm vào mNH4NO3 có trong dd sau phản ứng.
11. Tính khối lượng muối thu được khi cho hỗn hợp sắt và các oxit sắt tác dụng với HNO3 dư giải phóng khí NO:
mmuối= |
12. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng HNO3 đặc, nóng, dư giải phóng khí NO2:
mmuối= |
Lưu ý:
+ Hỗn hợp không nhất thiết phải đủ bốn chất vẫn có thể áp dụng được công thức.
+ Dạng toán này, HNO3 phải dư để muối thu được là Fe (III). Không được nói HNO3 vừa đủ vì có thể phát sinh Fe dư khử Fe3+ về Fe2+ :
+ Nếu giải phóng hỗn hợp NO và NO2 thì công thức là:
mmuối = |
13. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng H2SO4 đặc, nóng, dư giải phóng khí SO2:
mmuối = |
Lưu ý: Hỗn hợp không nhất thiết phải đủ 4 chất vẫn có thể áp dụng được công thức.
14. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO:
mFe = |
15. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO2:
mFe= |
16. Tính VNO (hoặc NO2) thu được khi cho hỗn hợp sản phẩm sau phản ứng nhiệt nhôm (hoàn toàn hoặc không hoàn toàn) tác dụng với HNO3:
nNO = hoặc nNO2 = 3nAl + (3x -2y)nFexOy |
17. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
m = |
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
m = |
18. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
m = |
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
m = |
Chương 8: Phân biệt một số chất vô cơ
- Dưới đây là bảng dấu hiệu nhận biết một số hợp chất vô cơ thường gặp:
Hoá chất | Thuốc thử | Hiện tượng | Phương trình minh hoạ |
- Dd axit - Dd bazơ (kiềm) | Quỳ tím | - Dd xit làm quỳ tím hoá đỏ. - Dd bazơ làm quỳ tím hoá xanh. | |
Dd muối sunfat hoặc H2SO4 | - BaCl2 - Ba(OH)2 | Tạo kết tủa trắng không tan trong axit mạnh | H2SO4 + BaCl2 →BaSO4+ 2HCl Na2SO4 + Ba(OH)2 → BaSO4+ 2NaOH |
Dd muối sunfit. | - BaCl2 - Axit | - Tạo kết tủa trắng. - Tạo khí không màu, mùi hắc. | Na2SO3 + BaCl2 → BaSO3+ 2NaCl Na2SO3 + 2HCl → BaCl2 + SO2 ↑+ H2O |
Dd muối cacbonat | - Axit - BaCl2 | -Tạo khí không màu. -Tạo kết tủa trắng. | CaCO3 +2HCl→ CaCl2 + CO2 ↑+ H2O Na2CO3 + BaCl2 → BaCO3 ↓+ 2NaCl |
Dd muối photphat | AgNO3 | - Tạo kết tủa màu vàng | Na3PO4+ 3AgNO3 → Ag3PO4↓ + 3NaNO3 |
Dd muối clorua hoặc HCl | AgNO3 | Tạo kết tủa trắng | HCl + AgNO3 → AgCl↓ + HNO3 NaCl + AgNO3 → AgCl↓ + NaNO3 |
Dd muối sunfua | Pb(NO3)2 | Tạo kết tủa đen. | Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3 |
Dd muối sắt (II) | Dung dịch kiềm (NaOH; KOH ...) | Tạo kết tủa trắng xanh, sau đó bị hoá nâu ngoài không khí. | FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl 4Fe(OH)2 + O2 + 2H2O →4Fe(OH)3 ↓ |
Dd muối sắt (III) | Tạo kết tủa màu nâu đỏ | FeCl3 + 3NaOH →Fe(OH)3 ↓ + 3NaCl | |
Dd muối magie | Tạo kết tủa trắng | MgCl2 + 2NaOH→ Mg(OH)2 ↓ + 2NaCl | |
Dd muối đồng | Tạo kết tủa xanh lam | Cu(NO3)2 + 2NaOH →Cu(OH)2 ↓ + 2NaNO3 | |
Dd muối nhôm | Tạo kết tủa trắng, tan trong kiềm dư | AlCl3 + 3NaOH →Al(OH)3 ↓+ 3NaCl Al(OH)3 + NaOH (dư) →NaAlO2 + 2H2O | |
∗ NHẬN BIẾT CHẤT KHÍ
KHÍ | THUỐC THỬ | HIỆN TƯỢNG | PHƯƠNG TRÌNH HÓA HỌC MINH HỌA | |
1. | SO2 | - dd Br2 - dd KMnO4 | - Mất màu nâu đỏ - Mất màu tím | SO2 + Br2 + 2H2O → 2HBr + H2SO4 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 . |
2. | H2S | - Pb(NO3)2 - Cu(NO3)2 - dd Br2 - dd KMnO4 | - ↓ đen - ↓ đen - Mất màu nâu đỏ - Mất màu tím | H2S + Pb(NO3)2 → PbS↓ + 2HNO3 H2S + Cu(NO3)2 → CuS↓ + 2HNO3 H2S + 4Br2 + 4H2O → 8HBr + H2SO4 5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O |
3. | CO2 | - nước vôi trong dư - Ba(OH)2 dư | ↓trắng | CO2 + Ca(OH)2 → CaCO3↓ + H2O CO2 + Ba(OH)2 → BaCO3↓ + H2O |
| 4. | NH3 | - Quỳ tím ẩm - Axit HCl đậm đặc | - Hóa xanh - Khói trắng | NH3 (k) + HCl(k) → NH4Cl(r) |
5. | HCl | - Quỳ tím ẩm - Dd AgNO3 | - Hóa đỏ - ↓trắng | AgNO3 + HCl → AgCl ↓ + HNO3 |
6. | CO | CuO, to | CuO đen đỏ, khí bay ra làm đục dd Ca(OH)2 | CuO (đen) + CO→ Cu (đỏ) + CO2 CO2 + Ca(OH)2 → CaCO3↓ + H2O |
7. | Cl2 | - Quỳ tím ẩm - dd KI, hồ tinh bột. | - Quỳ tím ẩm chuyển đỏ sau đó mất màu - Làm xanh hồ tinh bột | -Cl2 + H2O⇄ HCl + HClO Lúc đầu quỳ tím chuyển đỏ sau đó nhanh chóng mất màu do tác dụng tẩy màu của HClO -Cl2 + 2KI → 2KCl + I2 I2 sinh ra làm xanh hồ tinh bột. |
8. | H2 | CuO, to | CuO đen →đỏ | CuO (đen) + H2→ Cu (đỏ) + H2O |
9. | O2 | Que đóm còn tàn đỏ | Que đóm bùng cháy | C + O2 → CO2 |
10. | O2 | dd KI + hồ tinh bột | Xanh hồ tinh bột | O3 + 2KI + H2O → I2 + O2 + 2KOH I2 sinh ra làm xanh hồ tinh bột. |
Xem chi tiết tại đây.
- Lượt tải: 11.117
- Lượt xem: 148.569
- Dung lượng: 648,1 KB









 Hóa học 12
Hóa học 12 